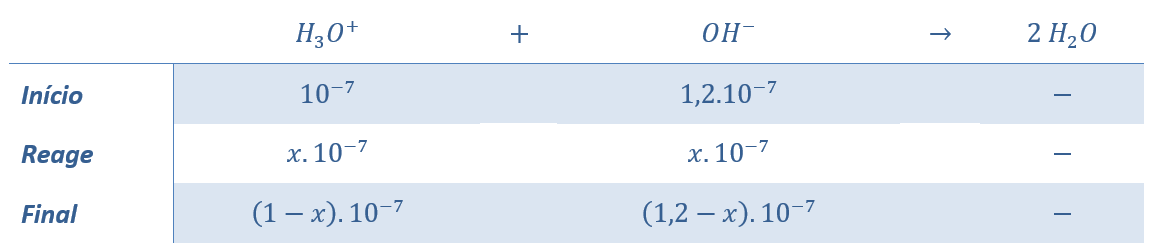A prova do ITA – 2020 foi, na minha opinião, a mais difícil dos últimos 10 anos. Fiquei muito feliz também por ter cobrado a Química mais objetiva, sem questões estranhas que fogem ao escopo do Ensino Médio.
Aponto duas questões que, na minha visão, foram nulas. Embora a ideia delas seja muito interessante e que seriam as duas melhores questões da prova, não há gabarito entre as alternativas do enunciado.
A questão 60, após devidamente balanceada, encontramos 52 como soma dos coeficientes. Esse valor não está entre as alternativas do enunciado.
Na questão 61, após considerar a hidrólise da água, encontramos a concentração de íons H3O+ igual a 9.10-8 mol/L, que não está previsto nas alternativas do enunciado.
Poderíamos até encontrar 8,3.10-8 mol/L, mas, para isso, teríamos que adotar uma linha de pensamento errada, que desconsideraria a existência inicial de íons H3O+ na água pura.
Prova ITA 2020
Questão 56
Considere as afirmações a seguir:
I – O ácido tricloroacético é um ácido mais fraco que o ácido propanoico.
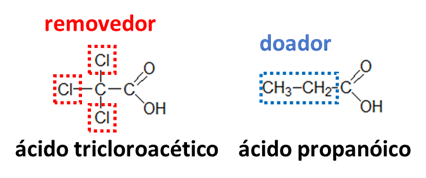
II – O 2, 4, 6-tricloro-fenol possui um caráter ácido maior que o 2,4,6-trinitro-fenol.
III – Reações de hidratação de alcinos geram produtos tautoméricos.
IV – Anéis benzênicos sobrem reações de substituição pela interação com reagentes eletrofílicos, enquanto haletos orgânicos sofrem substituição pela interação com reagentes nucleófilos.
Das afirmaçõea cima, está(ão) CORRETA(S)
A ( ) apenas I
B ( ) apenas I e II
C ( ) apenas II e III
D ( ) apenas III e IV
E ( ) apenas IV
Resolução Comentada
I – O caráter ácido de um ácido substância orgânica aumenta com a adição de grupos removedores de elétrons.
O ácido tricloroacético apresenta três grupos cloro, que são removedores de elétrons. Portanto, tem o caráter ácido mais intenso do que o ácido propanoico, que apresenta apenas o grupo etil, que é um grupo doador. Afirmação errada.
II – Esse item é bastante análogo ao item anterior. Porém, devemos saber que o grupo nitro é um grupo removedor muito forte, enquanto o grupo cloro é apenas um grupo removedor fraco. Portanto, o ácido com substituintes –NO2 é mais forte que o ácido com o substituinte –Cl. Afirmação errada.
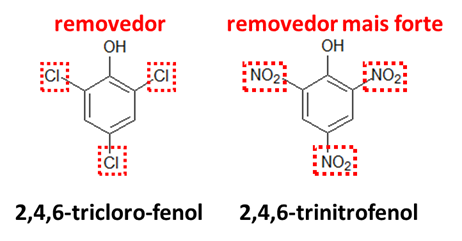
III – As reações de hidratação de alcinos formariam, a princípio, enóis. Porém, os enóis se tautomerizam em aldeídos ou cetonas. Vejamos um exemplo.
Afirmação correta.
IV – Esse é um item para ser decorado. Uma reação característica de compostos aromáticos é a substituição eletrofílica. Uma reação característica de haletos orgânicos é a substituição nucleofílica. Afirmação correta.
Gabarito: D
Questão 57
Considere uma bateria de fluxo de hidrogênio gasoso e bromo líquido
operando nas condições padrão. Durante a descarga, a bateria converte
e
em ácido bromídrico (HBr). As reações de meia célula e os respectivos potenciais – padrão de eletrodo, a 298K, são:
Anodo,
Catodo,
A dissociação da água pode ser observada pelo efeito da seguinte semirreação:
A formação de complexos iônicos de polibrometo ocorre segundo as reações e suas respectivas constantes de equilíbrio:
Sejam feitas as seguintes afirmações a respeito dessa bateria:
I – O potencial da célula pode ser aproximado pela equação: .
II – O solvente (água) é termodinamicamente estável somente a pH < 2,4.
III – Recarregar a bateria com um potencial catódico inferior a 1,229 V garante a estabilidade do solvente.
IV – Durante a descarga da bateria, a concentração de HBr aumenta e podem formar complexos iônicos de .
Das afirmações acima, estão CORRETAS:
A ( ) apenas I, II e IV
B ( ) apenas I e III
C ( ) apenas II e IV
D ( ) apenas III e IV
E ( ) todas
Resolução Comentada
O ITA diz que todo o sistema opera nas condições padrão. Embora seja condição padrão, devemos considerar que as concentrações dos íons da água podem ser diferentes de 1 mol.L–1.
I – Primeiramente, vamos escrever a equação geral da célula.
Para isso, notemos que o eletrodo do hidrogênio já foi fornecido como oxidação e o bromo como redução. Basta montar a reação global.
(oxidação)
(redução)
Para calcular o potencial da reação, devemos recorrer à equação de Nernst.
Nessa reação, estão envolvidos 2 mols de elétrons. Além disso, a expressão do coeficiente de ação de massas é:
Como o eletrodo opera nas condições padrão, consideraremos a concentração do brometo é igual a 1 mol L-1 e que a pressão parcial do hidrogênio é igual a 1 atm. Com isso, temos:
Agora, vamos substituir na Equação de Nernst
Usando as propriedades do logaritmo, temos:
Agora, usando a definição de pH, temos:
Afirmação correta.
II – Considere a reação de quebra do solvente por oxidação e seu potencial padrão.
(oxidação)
O potencial padrão dessa reação é igual a – 1,229 V. Porém, o potencial real é função do pH. Podemos, inclusive calcular pela Equação de Nernst, o que será feito mais adiante.
Para promover essa reação, devemos procurar a reação envolvida que tenha o maior potencial de redução. No caso, é a própria reação do bromo.
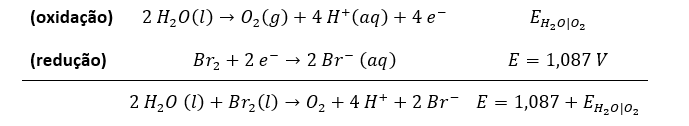
A quebra do solvente será espontânea para:
O coeficiente de ação de massas da reação é:
Como o sistema opera nas condições padrão, a pressão parcial do oxigênio é igual a 1 atm.
Usando as propriedades do logaritmo e a definição de pH, temos:
Portanto, o pH igual a 2,4 é realmente a situação limite para estabilidade do solvente. Afirmação correta.
III – De fato, como o potencial de quebra da molécula de água por oxidação é igual a 1,229 V, essa eletrólise pode ser induzida por uma bateria que tenha uma voltagem superior. Afirmação correta.
IV – Sim. Como falado no enunciado, a formação dos íons polibrometo (Br3 – e Br5–) é favorável, tendo uma constante de equilíbrio razoável.
Afirmação correta.
Portanto, todas as afirmações estão corretas.
Na correção em vídeo, não consideramos que a água poderia ser oxidada pelo bromo. Portanto, o ITA está correto.
Gabarito: E
Questão 58
A amônia, uma das principais matérias-primas da indústria de fertilizantes, é produzida em escala industrial pelo processo conhecido como Haber-Bosch. Neste, uma reação entre H2(g) e N2(g) é catalisada com ferro em um reator mantido a 200 atm e 450 °C. Sobre essa reação exotérmica, sejam feitas as seguintes proposições:
I. O aumento da pressão no reator, mediante adição de um gás inerte, aumenta o rendimento do processo.
II. Ouso de um catalisador mais efetivo aumenta o rendimento do processo.
III. Uma vez atingido o equilíbrio, não ocorrem mais colisões efetivas entre moléculas de H2(g) e N2(g).
IV. Considerando que ainda exista superação da energia de ativação, a redução da temperatura no reator diminui a velocidade da reação, mas favorece a formação de amônia.
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a reação de formação da amônia.
A ( ) apenas I.
B ( ) apenas I e II.
C ( ) apenas II e III.
D ( ) apenas III e IV.
E ( ) apenas IV.
Resolução Comentada
Primeiramente, vamos escrever a reação balanceada entre nitrogênio e hidrogênio que produz a amônia.
I – O aumento de pressão, mediante adição de gás inerte, não influencia o equilíbrio, porque não afeta as pressões parciais dos gases envolvidos.
Vejamos a expressão do coeficiente de ação de massas para essa reação.
Observe que o coeficiente de ação de massas depende somente das pressões parciais dos gases participantes da reação. Não é influenciado, portanto, pela mera adição de gás inerte. Afirmação errada.
II – O catalisador acelera a reação tanto no sentido direto como no sentido inverso, portanto, não afeta o equilíbrio. Afirmação errada.
III – O equilíbrio químico é dinâmico. Isso significa que tanto a reação direta como a reação inversa continuam acontecendo, porém, em velocidades iguais. Portanto, as colisões efetivas entre as moléculas de reagentes continuam a acontecer após atingido o equilíbrio. Afirmação errada.
IV – A redução de temperatura torna qualquer reação química mais lenta. Em relação ao equilíbrio, a menor temperatura favorece sempre o sentido exotérmico, que, no caso, é a produção de amônia. Portanto, afirmação correta.
Gabarito: E
Questão 59
A chama de uma vela é o exemplo mais comum de chama difusiva, na qual o oxigênio difunde-se em direção à parafina. Essa parafina pode apresentar diferentes tamanhos de cadeia carbônica. Com essas informações, considere as seguintes proposições:
I. A parafina da vela é constituída por moléculas de fórmula molecular , em que
.
II. A combustão da parafina na vela tem como principais produtos: negro de fumo, monóxido de carbono, dióxido de carbono e água.
III. A cor amarela da parte superior da chama indica um processo de combustão que depende da difusão do oxigênio presente no ar.
IV. Na região inferior da chama há coloração levemente azulada por conta da maior quantidade de oxigênio difundido pelas zonas de recirculação.
Das afirmações acima, está(ão) CORRETA(S)
A ( ) apenas I e II.
B ( ) apenas I, II e III.
C ( ) apenas I e IV.
D ( ) apenas II, III e IV.
E ( ) apenas III e IV.
Resolução Comentada
Vamos analisar as afirmações.
I – A parafina da vela é, de fato, constituída por hidrocarbonetos, ou seja, pela fórmula geral CxHy. Porém, é importante observar que, como a vela é sólida, ela não pode ser formados por hidrocarbonetos de cadeia curta. Os hidrocarbonetos com menos de 8 carbonos são sólidos ou líquidos à temperatura ambiente. Portanto, a vela deve ser formada por hidrocarbonetos de cadeia mais longa. Afirmação errada.
II – A combustão completa dos hidrocarbonetos libera CO2 e H2O. Porém, na vida prática, é bastante comum também a combustão incompleta, que, no caso de hidrocarbonetos, libera aldeídos, carbono grafite (ou negro de fumo) e monóxido de carbono. Portanto, embora o ITA não tenha entrado no detalhe dos aldeídos, a afirmação está corretíssima.
III – A cor amarela da chama é, de fato, resultante da liberação de calor gerada pela combustão da parafina. E, como qualquer combustão, ela depende da difusão do oxigênio presente no ar. Afirmação correta.
IV – A chama azul indica uma chama mais fria, portanto, é resultado de uma menor difusão de oxigênio. Além disso, vale notar que a parte inferior da chama realmente tem um suprimento de oxigênio menor que a parte superior, pois está mais distante do ar atmosférico. Afirmação correta.
Gabarito: D
Questão 60
O tiocianato de cobre é um condutor sólido do tipo p com aplicações optoeletrônicas e fotovoltaicas, como células solares. O CuSCN reage com o iodato de potássio na presença de ácido clorídrico para formar sulfato de cobre, ácido cianídrico, cloreto de potássio e monocloreto de iodo. O valor da soma dos menores coeficientes estequiométricos inteiros da reação líquida é igual a
A ( ) 32
B ( ) 36
C ( ) 49
D ( ) 50
E ( ) 54
Resolução Comentada
Esse é um dos balanceamentos mais difíceis que já vi na minha vida. Muito interessante.
Segundo o próprio enunciado, os reagentes são: CuSCN, iodato de potássio e ácido clorídrico.
Agora, vamos anotar os produtos: sulfato de cobre, ácido cianídrico, cloreto de potássio e monocloreto de iodo. Também podemos sempre considerar a presença de água em algum dos lados da reação.
Vamos registrar todos os elementos que variam o seu número de oxidação.
- Oxidação: O cobre passa de +1 em CuSCN para +2 em CuSO4;
- Oxidação: O enxofre passa de -2 em CuSCN para +6 em CuSO4;
- Redução: O carbono passa de +4 em CuSCN para +2 em HCN;
- Redução: O iodo passa de +5 em KIO3 para +1 em ICl;
Vamos marcar as variações dos números de oxidação dos elementos destacados acima.

Agora, vamos utilizar o princípio de que o número de elétrons ganhos é igual ao número de elétrons perdidos. Note que:
- O cobre perde 1 elétron;
- O enxofre perde 8 elétrons;
- O carbono ganha 2 elétrons;
- O iodo ganha 4 elétrons.
Agora, vamos ponderar cada elemento pelo seu respectivo coeficiente estequiométrico.
Resolvendo a equação, temos:
Podemos assumir a = 4 e b = 7.
Agora, podemos balancear pelo Método das Tentativas. Temos 4 átomos de cobre do lado dos reagentes, portanto, precisamos de 4 átomos no lado dos produtos. Logo, precisamos do coeficiente 4 CuSO4. Esse coeficiente balanceia automaticamente os átomos de enxofre.
Temos 4 átomos de carbono no lado dos reagentes, portanto, precisamos de 4 átomos de carbono no lado dos produtos. Portanto, precisamos do coeficiente 4 HCN, que também balanceia os átomos de nitrogênio automaticamente.
Agora, vamos balancear os átomos de potássio e iodo presentes no iodato de potássio (KIO3).
Temos 7 átomos de potássio no lado dos reagentes, logo, precisamos de 7 átomos no lado dos produtos. Portanto, precisamos do coeficiente 7 KCl.
Temos 7 átomos de iodo no lado dos reagentes. Portanto, precisamos do coeficiente 7 ICl para chegar a 7 átomos de iodo no lado dos produtos.
Vamos balancear, agora, os átomos de cloro. Observe que temos 14 átomos de cloro nos produtos (7 em KCl e 7 em ICl). Portanto, precisamos de 14 átomos no reagente, ou seja, precisamos do coeficiente 14 HCl.
Agora, vamos balancear os átomos de hidrogênio. Temos 14 átomos de hidrogênio no lado dos reagentes. Portanto, precisamos de 14 átomos nos produtos. Já temos 4 átomos no HCN, portanto, precisamos de mais 10 que virão da água. Logo, precisamos do coeficiente 5 H2O.
Podemos conferir se a equação está, de fato, balanceando conferindo os átomos de oxigênio.
No lado dos reagentes, temos 21 átomos de oxigênio encontrados em 7 KIO3. Do lado dos produtos, encontramos 16 átomos em 4 CuSO4 e 5 átomos de oxigênio em 5 H2O.
Sendo assim, o número de átomos de oxigênio está balanceado. Logo, chegamos ao balanceamento completo da nossa reação.
O que foi pedido foi a soma dos coeficientes estequiométricos.
Como a soma dos coeficientes estequiométricos encontrado foi igual a 52, a questão está nula.
Gabarito: NULA
Questão 61
Em um experimento realizado a 298 K foram adicionados 20,0 mL de HCl 1,5.10-4 mol L-1 a 0,48 L de uma solução de limpeza contendo 3,01.10-6 mol de uma base forte hipotética XOH. O valor da concentração de H3O+,em mol L-1, na solução resultante é igual a
A ( ) 1,0 . 10-8
B ( ) 8,3 . 10-8
C ( ) 1,0 . 10-7
D ( ) 1,2 . 10-7
E ( ) 8,2 . 10-7
Resolução Comentada
Primeiramente, note que o enunciado foi bastante maldoso com o aluno. No enunciado, foram fornecidos: a concentração molar do HCl e o número de mols da base forte. Em uma leitura rápida, o aluno facilmente leria que havia 3,01.10-6 mol/L da base. Porém, não é isso que consta no enunciado.
Esclarecido esse ponto, vamos calcular o número de mols do HCl e da base KOH.
Agora, vamos montar a tabela estequiométrica correspondente à reação, notando que o HCl é o reagente limitante da reação.

Houve um excesso, portanto, de 0,01.10-6 mol da base. Sendo assim, a concentração adicional de íons OH– é:
Como a concentração de OH– foi muito baixa, devemos levar em consideração a hidrólise da água pura. Na água pura, já se encontram originalmente presentes 10—7 mol/L de íons H3O+ e OH–.
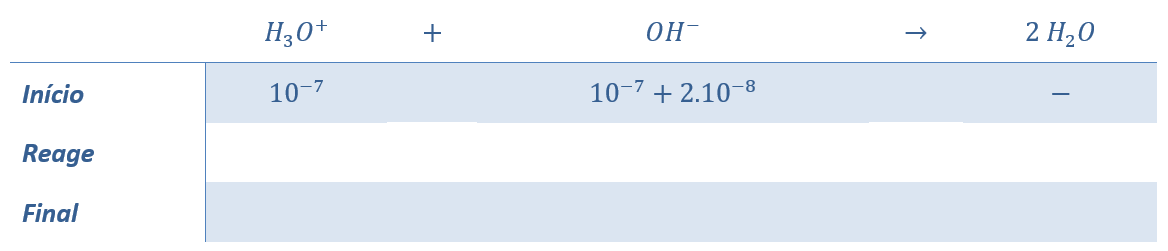
Observe que a adição de base de 2.10-8 mol de base provocou uma perturbação no produto iônico da água.
Aplicando o produto iônico da água, temos:
Podemos simplificar o 10-14 de ambos os lados.
Fazendo o produto cruzado no lado esquerdo, temos:
Agora, vamos
Observe que devemos tomar a solução com o sinal negativo, pois a solução com sinal positivo, faria que x > 1,2, portanto, as concentrações dos íons H3O+ e OH– seriam negativas, o que não é possível.
Sendo assim, podemos calcular a concentração de íons H3O+ pedida:
Não é possível, portanto, encontrar nenhum gabarito. Logo, a questão, infelizmente, é nula. Na hora da prova, seríamos tentados a marcar a letra B (8,3.10–8), que é o valor mais próximo.
Convém ressaltar que poderíamos encontrar um gabarito fazendo a seguinte conta.
Considerando que a base provoca um aumento de concentração de íons OH– igual a 2.10-8 mol/L, teríamos que:
Se utilizássemos agora o produto iônico da água, teríamos:
Com isso, encontraríamos a letra B. Porém, essa conta está errada, tendo em vista que não se levou em consideração a quantidade de H3O+ presentes inicialmente na água nem que a adição de base provoca um desequilíbrio iônico, de modo que a diferença deve ser exatamente igual à quantidade de base adicionada.
Por isso, preferimos considerar a questão nula.
Havíamos indicado que provavelmente o gabarito viria B, mas a questão está nula porque a resposta correta seria 9.10-8 mol/L. O ITA, de fato, considerou letra B.
Gabarito ITA: B / Meu Gabarito: NULA
Questão 62
Um reator com 200 L de capacidade, possui uma mistura de dióxido de nitrogênio e monóxido de carbono a 400 K, cujo comportamento pode ser considerado ideal. Os gases reagem entre si para formar dióxido de carbono e monóxido de nitrogênio. A pressão total no reator é igual a 32,8 atm e, no início da reação, a pressão parcial do monóxido de carbono é três vezes maior que a do dióxido de nitrogênio. As massas iniciais de dióxido de nitrogênio e de monóxido de carbono são, respectivamente,
A ( ) 1,5 kg e 4,2 kg.
B ( ) 1,5 kg e 4,5 kg.
C ( ) 1,5 kg e 6,6 kg.
D ( ) 2,3 kg e 4,2 kg.
E ( ) 2,3 kg e 6,6 kg.
Resolução Comentada
Vamos escrever a reação entre o dióxido de nitrogênio e o monóxido de carbono.
Observe que a reação já está balanceada e que o número de mols de gás nos produtos é igual ao número de mols de gás nos reagentes. Sendo assim, não ocorre variação de pressão durante a reação. Logo, podemos dizer que a pressão total inicial era igual a 32,8 atm.
Como a pressão parcial do CO é igual ao triplo da pressão parcial de NO2, podemos escrever:
Agora que conseguimos calcular a pressão parcial, podemos calcular o número de mols de NO2 usando a Equação de Clapeyron.
Temos, portanto, que o número de mols de NO2 presentes no sistema reacional é:
Observe, ainda, que a pressão parcial é proporcional ao número de mol do gás. Logo, se a pressão parcial de CO é igual ao triplo da pressão parcial de NO2, podemos concluir que o número de mols de CO é igual ao triplo do número de mols de NO2.
Agora, precisamos calcular as massas presentes das duas substâncias. Para isso, basta multiplicar o número de mols pela massa molar. Primeiramente, vamos calcular as massas molares de NO2 e CO.
Agora, basta multiplicar.
Gabarito: D
Questão 63
Polímeros são moléculas muito grandes constituídas por milhares de átomos. Tais macromoléculas são classificadas em duas categorias: naturais e sintéticas. Os naturais têm como exemplos as proteínas, ácidos nucleicos e borrachas, enquanto os sintéticos são compostos orgânicos tais como a polihexametilenoadipamida (Nylon) e o poli(metacrilato de metila). Nesse contexto, considere as seguintes afirmações:
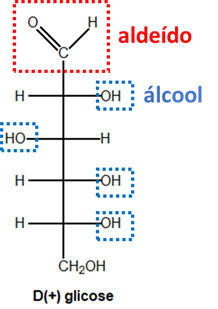
(1) A glicose é um álcool-aldeído que polimeriza para formar o amido e a celulose.
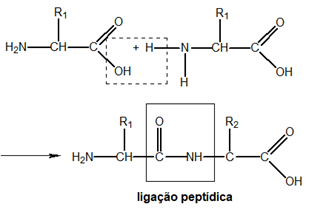
(2) A estrutura primária de um polipeptídeo é a sequência de resíduos de aminoácidos.
(3) Os polímeros formados por cadeias longas tendem a ter alta viscosidade.
(4) Os álcoois condensam com ácidos carboxílicos para formar ésteres.
(5) As amidas resultam da condensação de aminas e ácidos carboxílicos.
A soma dos números associados às afirmativas CORRETAS é igual a:
( ) 8
( ) 10
( ) 12
( ) 13
( ) 15
Resolução Comentada
Vamos analisar as afirmações propostas.
- Isso mesmo. A glicose é um aldeído que apresenta vários grupos álcool. De fato, alguns de seus polímeros são o amido e a celulose. Afirmação correta.
- Em uma cadeia polipeptídica, vários aminoácidos se ligam por uma ligação peptídica. Ocorre a perda de uma molécula de água, portanto, o aminoácido inteiro não permanece na proteína, apenas um resíduo. Exatamente como disse o enunciado. Afirmação correta.
- Quanto mais longa a cadeia do polímero, maiores as forças intermoleculares, portanto, ele tende a ter maior viscosidade. Afirmação correta.
- Os álcoois e os ácidos carboxílicos reagem pela esterificação de Fischer formando ésteres. Afirmação correta.
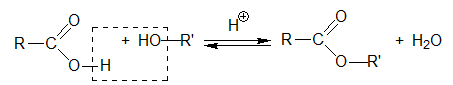
- De forma semelhante à esterificação de Fischer, as aminas condensam com ácidos carboxílicos formando amidas. Afirmação correta.
Todas as afirmações estão corretas, portanto, a soma é igual a:
S=1+2+3+4+5=15
Gabarito: E
Questão 64
Quando dissolvidos em água para formar soluções com concentração 0,1 mol L-1, os sais Na2S, NaCH3CO2, NaHSO4 e Na2HPO4 deixam o meio respectivamente
( ) ácido, básico, neutro, básico.
( ) básico, neutro, ácido, neutro.
( ) ácido, básico, ácido, ácido.
( )básico, básico, ácido, básico.
( ) neutro, neutro, básico, neutro
Resolução Comentada
Os sais são formados pelo íon sódio, que jamais sofre hidrólise.
Os ânions de ácidos fracos todos sofrem hidrólise, liberando OH–.
Assim, as soluções de Na2S, NaCH3CO2 e Na2HPO4 são básicas.
O bissulfato, por sua vez, é um ânion de um ácido forte. Portanto, ele não sofre hidrólise, liberando OH–. Além disso, esse íon contém um H+, portanto, ele pode sofrer ionização, liberando um íon H3O+.
A ionização do bissulfato corresponde exatamente à segunda ionização do ácido sulfúrico, que é bastante significativa (Ka2 = 10-2). Portanto, a solução de bissulfato de sódio (NaHSO4) é ácida.
Gabarito: D
Questão 65
Turbinas a gás podem operar com diversos tipos de combustível. Alguns dos mais comuns são metano, etanol e querosene (C12H26). Considerando combustão completa, a razão mássica de mistura entre cada um desses combustíveis e o oxigênio é, respectivamente,
( ) 0,25; 0,48 e 0,29.
( ) 0,25; 0,48 e 0,57.
( ) 0,25; 0,96 e 0,57.
( ) 0,50; 0,48 e 0,29.
( ) 0,50; 0,96 e 0,57.
Resolução Comentada
Vamos escrever a reação de combustão balanceada para cada uma das espécies químicas citadas.
Considerando 1 mol de cada um dos combustíveis, podemos calcular as massas presentes do combustível e do oxigênio na reação.
Mas, para isso, precisamos das massas molares do metano (CH4), etanol (C2H6O) e do querosene (C12H26) e do oxigênio (O2).
Agora, vamos calcular as proporções mássicas pedidas.
- Combustão do Metano:
- Combustão do Etanol:
- Combustão do Querosene:
Gabarito: A
Questão 66
Líquidos iônicos, ou sais que fundem à temperatura ambiente, são compostos iônicos que apresentam temperatura de fusão abaixo de 100 °C e que consistem de íons e pares iônicos não dissociados. Com base nessa definição, assinale a opção CORRETA sobre líquidos iônicos.
A ( ) NaCl fundido pode ser definido como um líquido iônico.
B ( ) CH3COOH anidro pode ser definido como um líquido iônico.
C ( ) A condutividade específica de líquidos iônicos é equivalente à da água.
D ( ) A pressão de vapor de líquidos iônicos é equivalente à de solventes orgânicos voláteis.
E ( ) Sais que apresentam cátions ou ânions relativamente grandes devem se comportar como líquidos
Resolução Comentada
Vamos analisar as afirmações propostas pelo enunciado.
A) Pela definição do enunciado, o cloreto de sódio não pode ser considerado um líquido iônico, porque ele se funde a uma temperatura bem superior a 100 °C. No caso, a temperatura de fusão é igual a 801 °C. Afirmação errada.
B) O ácido acético (CH3COOH) não pode ser considerado um líquido iônico, porque não é um composto iônico. Afirmação errada.
C) Os compostos iônicos são bons condutores de corrente elétrica. Portanto, sua condutividade é muito superior à da água. Afirmação errada.
D) Os líquidos iônicos apresentam forças intermoleculares muito superiores, portanto, não são voláteis. Logo, sua pressão de vapor deve ser muito inferior à de solventes orgânicos voláteis. Afirmação errada.
E) Quanto maiores os raios iônicos, menor será a energia reticular do sal. Isso acontece, porque a energia de atração entre cargas elétricas é inversamente proporcional à distância entre elas. Afirmação correta.
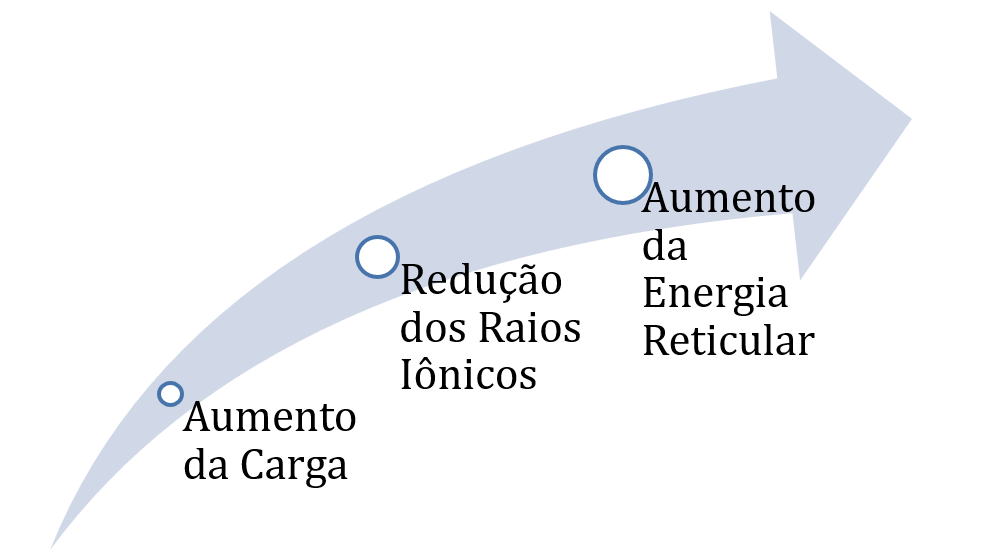
Gabarito: E
Questão 67
Considere as seguintes transformações:
I. Conversão de propanol em propanal;
II. Conversão de bromometano em metanol;
III. Conversão de etino em eteno;
IV. Reação de propanal em presença de íons prata;
V. Conversão de metano em bromometano;
As reações envolvidas em cada uma das transformações de I a V podem ser classificadas como de oxidação, redução, ou outra. Assinale a opção que contém corretamente o tipo de reação envolvida, do ponto de vista da molécula orgânica, em cada uma das transformações de I a V, respectivamente.
( ) Oxidação, redução, oxidação, oxidação, outra.
( ) Redução, outra, redução, outra, outra.
( ) Oxidação, outra, redução, oxidação, oxidação.
( ) Redução, oxidação, outra, outra, oxidação.
( ) Oxidação, oxidação, redução, oxidação, outra.
Resolução Comentada
Para determinar se houve oxidação ou redução de uma molécula orgânica, devemos calcular o número de oxidação do carbono.
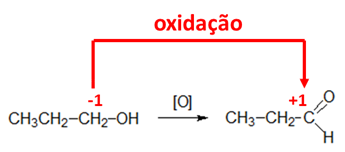
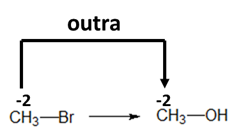
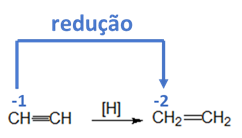
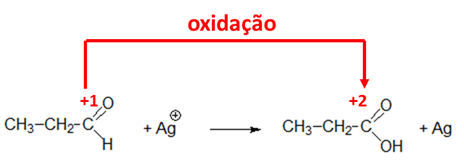

Gabarito: C
Questão 68
Considerando que o ar é composto aproximadamente de 21% de O2 e 79% de N2 em volume, tem-se que a razão molar ar/combustível da combustão completa de um determinado alcano é igual a 59,5. A partir desse dado, assinale a alternativa que corresponde à soma dos coeficientes estequiométricos de todas as substâncias presentes nessa reação.
( ) 30,5
( ) 55,5
( ) 82,0
( ) 112,0
( ) 124,5
Resolução Comentada
A fórmula geral de um alcano é CnH2n+2. Quando queimado, produzirá dióxido de carbono (CO2) e água (H2O).
Agora, vamos balancear a equação química. Se, do lado dos reagentes, temos n carbonos, precisamos do coeficiente n CO2 para balancear no lado dos produtos.
Do lado dos reagentes, temos 2n+2 hidrogênios, portanto, precisamos do coeficiente n+1 H2O para balancear no lado dos produtos.
Agora, basta balancear os oxigênios. Temos, no lado dos produtos:
Com isso, podemos balancear os oxigênio no lado dos reagentes.
Assim, a equação química balanceada é:
Pelas informações do enunciado, a razão molar entre a quantidade de ar e a quantidade de alcano é igual a 59,5. Porém, o ar contém apenas 21% do reagente (O2). Considerando 1 mol do alcano, temos que o número de mols de oxigênio presentes no sistema reacional é.
Esse deve ser, portanto, o coeficiente estequiométrico do gás.
De posse do valor de n, podemos escrever a equação de combustão.
Pela jurisprudência do ITA, como o enunciado falou em nitrogênio, devemos incluir o gás no reagente e nos produtos com o mesmo coeficiente estequiométrico.
O coeficiente estequiométrico pode ser obtido pela proporção molar no ar atmosférico. Considerando que o coeficiente do oxigênio é igual a 12,5 e sua fração molar no ar é igual a 21%, temos que o coeficiente do nitrogênio deve ser proporcional à sua fração molar que é 79%.
Portanto, vamos incluir
Agora, vamos calcular a soma dos coeficientes:
O ITA considerou os coeficientes estequiométricos do N2 (47 N2) nos lados dos reagentes e dos produtos, afetando o valor da soma. Discordo do ITA nesse ponto, porque o nitrogênio não participa da reação, logo, o seu coeficiente não deve ser considerado no balanceamento.
Gabarito: E
Questão 69
Considere que o ar seco ao nível do mar é composto de 4.10-2 % (em volume) de CO2. Sejam dadas a constante da lei de Henry para o CO2 e a constante da primeira dissociação do ácido carbônico, respectivamente, KH = 2,5.10-2 mol L-1 atm-1 e Ka = 1.10-6,4. Assinale a opção que apresenta a concentração em mol L-1 de CO2 dissolvido e o pH de uma amostra de água desionizada, após a mesma entrar em equilíbrio com o ar atmosférico.
A ( ) 10-2 e 6,4
B ( ) 10-5 e 5,7
C ( ) 10-5 e 6,4
D ( ) 10-7 e 5,7
E ( ) 10-7 e 6,4
Resolução Comentada
Considerando que a pressa atmosférica ao nível do mar é igual a 1 atm, a pressão parcial de CO2 corresponde ao percentual de 4.10-2% ou 0,04%. Portanto, podemos calcular a pressão parcial do gás.
Usando a Lei de Henry, podemos calcular a solubilidade do gás.
Além disso, o CO2 também se encontra em equilíbrio referente à sua primeira ionização.
Pela estequiometria da reação, o número de mols de H+ é igual ao número de mols de bicarbonato (HCO3–). Já a concentração de CO2 é exatamente igual a 10-5, pois é garantida pela solubilidade do gás.
Usando a definição de pH, temos:
Gabarito: B
Questão 70
Considere os seguintes experimentos e suas respectivas observações:
I. A uma solução de nitrato de prata é adicionada uma solução de cloreto de sódio, com a formação de um precipitado.
II. O precipitado obtido em (I) é filtrado e misturado a hidróxido de sódio sólido, com um pouco de água. A mistura é aquecida, produzindo um sólido marrom escuro.
III. O sólido preparado em (II) é aquecido junto a uma solução concentrada de glicose, formando um sólido cinzento.
Assinale a alternativa que apresenta corretamente os sólidos produzidos em I, II e III, respectivamente
A ( ) AgCl, Ag2O, Ag
B ( ) Ag, AgOH, Ag
C ( ) AgCl, AgOH, AgO
D ( ) Ag, Ag2O, Ag2C2
E ( ) AgCl, AgO, Ag2C2
Resolução Comentada
Vamos estudar os três experimentos.
I – O cloreto de prata é um precipitado insolúvel, formado na reação.
II – O cloreto de prata (AgCl) é formado pelo ácido clorídrico (HCl) com o hidróxido de prata. A adição de hidróxido de sódio (NaOH) provocará uma reação de dupla troca, em que o ácido clorídrico se associa à base mais forte.
Porém, na situação do problema, foi adicionado hidróxido de sódio a quente, que é um poderoso agente desidratante. Portanto, ele provocará a desidratação do hidróxido de prata, formando Ag2O.
III – Como a glicose é um aldeído, ela pode ser oxidada pelo óxido de prata, formando um espelho de prata. Essa reação é exatamente a mesma do Reagente de Tollens.
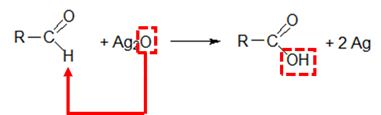
Gabarito: A
É isso, pessoal! Espero que tenham curtido a resolução da prova de Química da prova da 1ª Fase do Vestibular ITA 2020. Sigam-me nas redes sociais. Têm muitas dicas lá. Mande uma mensagem, caso tenha tido alguma dúvida. Abraços!
Instagram: @thiagofernando.pe